激素性股骨头坏死(SONFH)是一种临床上常见的进行性骨病,近年来发病率不断上升,占股骨头坏死总病例的25-51%。若不及时治疗,会导致股骨头结构改变及塌陷,引起髋关节疼痛及功能障碍。
研究表明,骨髓间充质干细胞(BMSC)可以促进骨修复,有望治疗早期激素性股骨头坏死。然而,SONFH有一个独特的病理因素,即患者股骨头坏死区的氧浓度通常低于1%,形成了局部缺氧微环境,可导致BMSC发生缺氧性凋亡,并限制了其成骨修复能力。因此,目前急需开发新方法来抑制缺氧引起的BMSC凋亡和提高BMSC移植的疗效。
贵州医科大学附属医院研究团队发现,长链非编码RNA Tmem235在这种缺氧环境中下调。他们通过一系列实验表明,Lnc Tmem235可抑制BMSC的缺氧性凋亡,从而改善BMSC治疗早期激素性股骨头坏死的效果。这项研究成果已发表在《Experimental & Molecular Medicine》杂志上。

文献封面截图[1]
研究材料与方法
在这项研究中,研究人员从雄性SD大鼠中提取出BMSC,并利用赛业OriCell®提供的大鼠BMSC成骨、成脂、成软骨诱导分化试剂盒验证了BMSC的诱导分化性能。然后,通过lncRNA芯片分析筛选出与BMSC缺氧性凋亡相关的lncRNA,并通过基因过表达和沉默分析来探究Lnc Tmem235抑制BMSC凋亡的具体机制。最后,利用雄性SD大鼠构建了早期激素性股骨头坏死模型,并在移植BMSC后利用micro-CT系统监测了骨结构和骨密度。
技术路线
探讨缺氧环境对BMSC的影响,通过lncRNA芯片和过表达等分析确定,Lnc Tmem235抑制了BMSC的缺氧性凋亡
通过过表达和干扰分析确定Lnc Tmem235通过调节BIRC5的表达,来抑制BMSC的缺氧性凋亡
深入分析机制后发现Lnc Tmem235与BIRC5 mRNA竞争性结合miR-34a-3p,从而促进BIRC5的表达
在早期激素性股骨头坏死模型中,Lnc Tmem235通过抑制BMSC的缺氧性凋亡,改善了BMSC移植的治疗效果
研究结果
01
Lnc Tmem235抑制BMSC的缺氧性凋亡
研究人员从骨髓中成功分离出BMSC,并探讨了不同缺氧环境对BMSC的影响。由于股骨头坏死区的氧气浓度低于1%,故他们用0%的氧气浓度来建立BMSC的体外缺氧模型。结果显示,BMSC暴露于缺氧环境后,线粒体膜电位和ATP水平下降,而ROS水平上升。同时,大量的BMSC发生凋亡。
考虑到lncRNA在细胞凋亡的调控中发挥重要作用,接下来有哪些lncRNA与缺氧诱导的BMSC凋亡有关呢?lncRNA芯片分析显示,在缺氧条件下有99个lncRNA上调,183个lncRNA下调。进一步分析表明,Lnc Tmem235在BMSC缺氧模型中的表达明显下调,且其表达随缺氧程度的加重和凋亡比例的增加而持续下调。这些结果表明,Lnc Tmem235可能与BMSC的缺氧性凋亡有关。
Lnc Tmem235基因座位于10号染色体上,处于BIRC5基因的下游。研究人员发现,Lnc Tmem235不具备编码蛋白质的能力,主要分布在BMSC的细胞质内。在缺氧条件下,Lnc Tmem235和Bcl-2的表达水平下调,Bax和CASP-3的表达水平上调,BMSC凋亡比例超过70%。然而,Lnc Tmem235的过表达逆转了这些结果,促进了BMSC在缺氧条件下的存活(图1)。这表明,Lnc Tmem235抑制了BMSC的缺氧性凋亡。
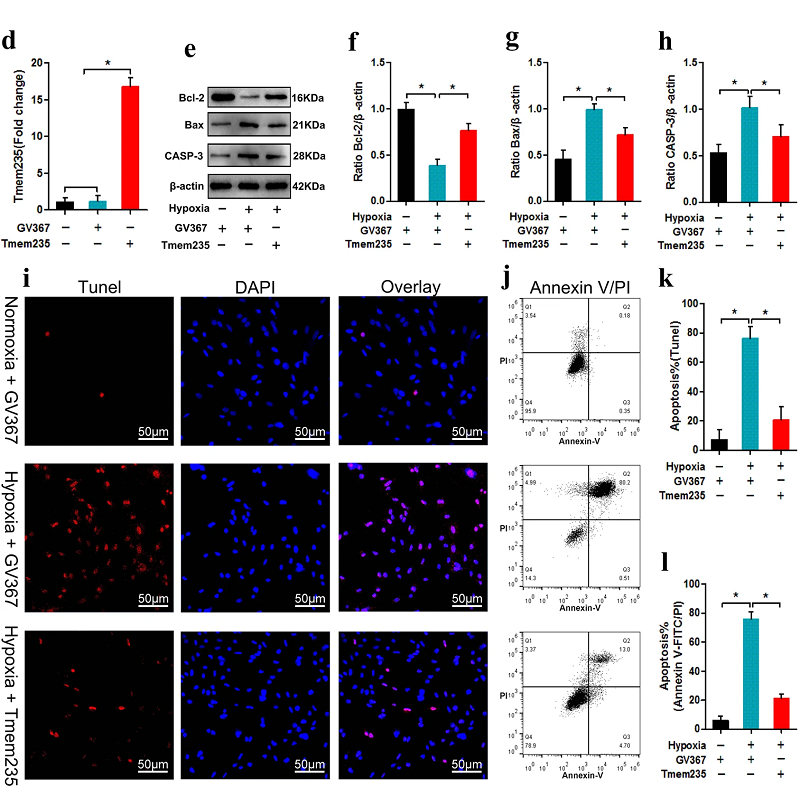
图1. Lnc Tmem235抑制了BMSC的缺氧性凋亡[1]
02
Lnc Tmem235通过调节miR-34a-3p/BIRC5轴抑制BMSC的凋亡
那么,Lnc Tmem235是通过何种机制抑制BMSC的缺氧性凋亡呢?研究人员在BMSC中过表达Lnc Tmem235后,通过芯片分析来检测细胞的基因表达谱,发现BIRC5的表达明显上调。之后的qPCR分析证实了芯片分析的结果。作为凋亡抑制剂,BIRC5可直接抑制CASP-3和CASP-9的活性,阻断细胞凋亡。因此,他们推测Lnc Tmem235通过调节BIRC5的表达来抑制BMSC凋亡。
在上调Lnc Tmem235的表达后,他们用慢病毒干扰载体下调了BIRC5的表达,发现BIRC5的下调明显削弱了Lnc Tmem235的抗凋亡作用。相反,在Lnc Tmem235表达被下调后,BIRC5的过表达有效减轻了缺氧诱导的BMSC凋亡。这些结果证实,Lnc Tmem235通过调节BIRC5的表达来抑制BMSC的缺氧性凋亡。
研究人员推测,也许有某个miRNA与BIRC5 mRNA结合,而Lnc Tmem235通过竞争性结合miRNA来释放miRNA对目标基因的沉默,最终促进BIRC5的表达。他们通过生物信息学工具将目标锁定为miR-34a-3p。
通过RIP分析,他们发现miR-34a-3p的过表达明显增加了Lnc Tmem235和BIRC5 mRNA在miRNA核糖核蛋白复合物(miRNP)中的富集。荧光素酶活性分析也显示,miR-34a-3p可以与Lnc Tmem235或BIRC5 mRNA上的预测位点结合。后续分析表明,Lnc Tmem235可作为ceRNA,与BIRC5 mRNA竞争性结合miR-34a-3p,从而解除miR-34a-3p对BIRC5 mRNA的沉默,最终促进BIRC5的表达。
当BMSC处于缺氧状态时,Lnc Tmem235的过表达导致BIRC5表达被上调,细胞凋亡明显减少。在此基础上上调miR-34a-3p的表达,则BIRC5表达下降,细胞凋亡增加。这表明miR-34a-3p阻断了Lnc Tmem235的抗凋亡作用。之后,研究人员又上调了BIRC5的表达,发现细胞凋亡减少(图2)。这些结果表明,Lnc Tmem235通过调节miR-34a-3p/BIRC5轴抑制了BMSC的缺氧性凋亡。
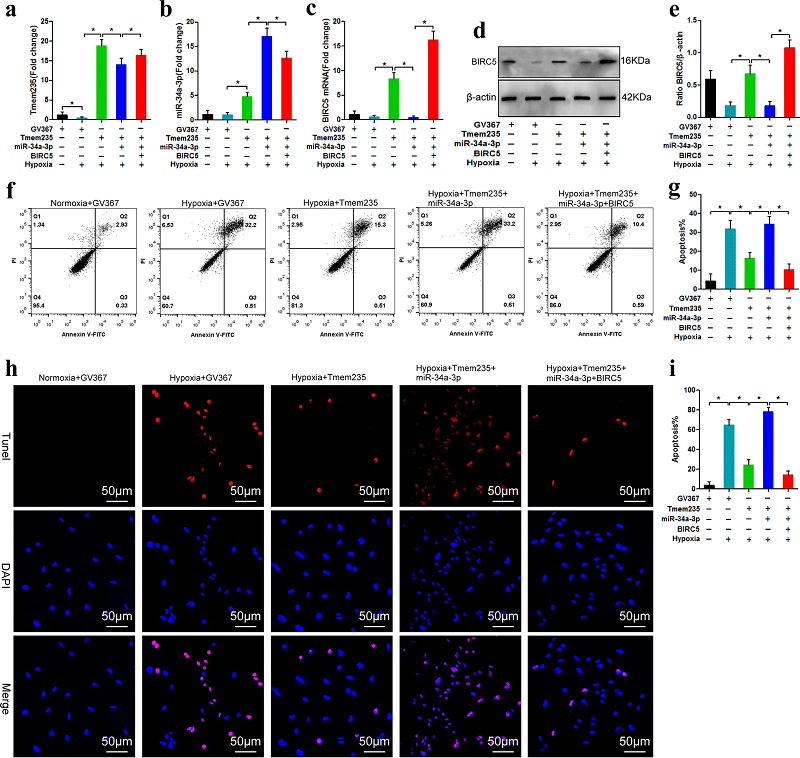
图2. Lnc Tmem235通过调节miR-34a-3p/BIRC5抑制了BMSC的缺氧性凋亡[1]
03
Lnc Tmem235促进早期激素性股骨头坏死的修复
此外,研究人员利用脂多糖和甲泼尼龙建立了早期激素性股骨头坏死模型。他们发现,在骨坏死区的缺氧微环境中,大量的移植BMSC出现缺氧诱导的凋亡,严重限制了BMSC移植的效果。既然Lnc Tmem235能够抑制BMSC的缺氧性凋亡,那么它是否能改善BMSC对早期SONFH的治疗效果?
他们在过表达或沉默Lnc Tmem235后,用DiR标记BMSC,并与异种脱抗原松质骨(XACB)共同培养来构建组织工程骨,以修复早期SONFH模型。与对照组相比,Lnc Tmem235过表达组的DiR荧光强度和BIRC5表达水平更高,TUNEL阳性细胞的比例明显下降,而在Lnc Tmem235低表达组中,TUNEL阳性细胞比例增加。这表明Lnc Tmem235抑制了缺氧微环境中BMSC的凋亡,促进了BMSC的存活。
在手术后12周,他们通过多个指标评估了BMSC的修复效果。与对照组相比,Lnc Tmem235过表达组的缺损区完全修复,且骨组织趋于成熟。骨小梁数目、骨小梁厚度、骨体积、骨体积分数以及多个成骨标志物的水平都明显增加。相反,Lnc Tmem235低表达组的各项指标都明显低于对照组。这些结果表明,Lnc Tmem235通过抑制BMSC的缺氧性凋亡,改善了BMSC对早期SONFH的治疗效果。
结论
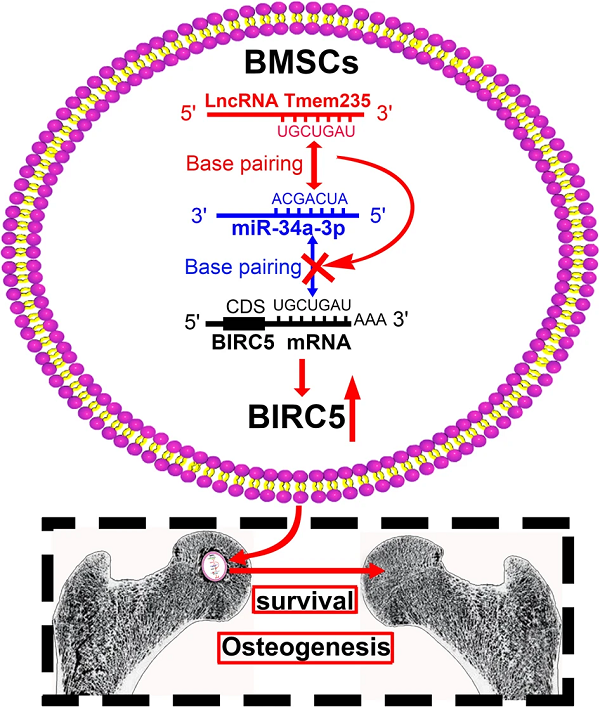
图3. Lnc Tmem235在通过移植BMSC修复早期SONFH中的作用和机制[1]
总的来说,这项研究表明Lnc Tmem235通过调节miR-34a-3p/BIRC5来抑制BMSC的缺氧性凋亡,而这种抑制改善了BMSC对早期激素性股骨头坏死的治疗效果(图3)。这项研究为减少BMSC的缺氧性凋亡和改善BMSC移植的疗效提供了一个新的靶点和方法。
地址:天津市东丽区空港经济区商务园西区W16
邮箱:2220082662@qq.com
电话:18902170332
